2020年11月25日,Y-mAbs公司宣布美国FDA已加速批准其Danyelza(naxitamab-gqgk)用于与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联合治疗对既往治疗表现出部分缓解、轻微缓解或疾病稳定的复发/难治性高危神经母细胞瘤儿童(1岁及以上)和成人患者。Danyelza曾被FDA授予优先审评资格、孤儿药资格、突破性疗法认定和罕见儿科疾病认定。本文就Danyelza的适应症、用法用量、副作用、禁忌、临床疗效等进行了详细说明。
(一)适应症
Danyelza与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联用,适用于治疗1岁及以上的儿童和成人患者的对既往治疗有部分反应、轻微反应或病情稳定的复发或难治性骨或骨髓高危神经母细胞瘤
(二)用法用量
1.推荐剂量
(1)Danyelza的推荐剂量为每个治疗周期的第1、3和5天3mg/kg/天(最高150mg/天),稀释后静脉滴注,联合GM-CSF皮下注射,见表1。参考GM-CSF处方信息了解推荐的剂量信息。
(2)治疗周期每4周重复一次,直到完全缓解或部分缓解,然后每4周再进行5个额外周期。后续周期可每8周重复一次。因疾病进展或不可接受的毒性停用Danyelza和GM-CSF。
(3)在输注过程中,酌情给予输注前药物和支持性治疗。
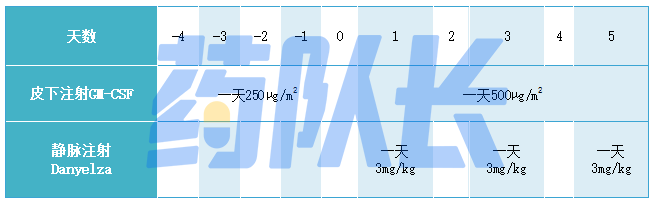
(5)每个治疗周期的推荐剂量方案如下表1所示:
①第-4天至第0天:在Danyelza输注前5天开始皮下注射GM-CSF 250µg/m2/天。
②第1~5天:皮下注射GM-CSF 500µg/m2/天。在第1、3、5天给药前至少1小时给药。
③第1、3、5天:静脉输注Danyelza 3mg/kg/天(最多150mg/天)。
表一 GM-CSF与Danyelza在一个治疗周期内的剂量及方案
(6)漏给剂量
如果漏给Danyelza剂量,则在下周(但最多不超过十天)注射错过的剂量,并在输注Danyelza的第一天、第二和第三次输注的前一天和当天分别注射GM-CSF 500µg/m2/天(即总共5天,注射500µg/m2/天)。
2.治疗前用药和辅助用药
(1)输液前和输液过程中的疼痛控制
①在每个周期首次输注Danyelza前5天,开始为期12天(第4天至第7天)的神经病理性疼痛预防药物治疗,如加巴喷丁(gabapentin)。
②每次开始输注Danyelza前45-60分钟口服阿片类药物,输注期间出现突破性疼痛时,根据需要追加静脉注射阿片类药物。
③对于阿片类药物无法充分控制的疼痛,可考虑使用氯胺酮。
(2)用药前:降低输液相关反应和恶心/呕吐的风险
①在首次输注Danyelza前30分钟至2小时静脉注射皮质类固醇(如甲基强的松龙2mg/公斤,最大剂量为80mg或同等剂量的皮质类固醇)。如果上一次输注或上一个周期中发生严重输注反应,则在随后的输注中使用皮质类固醇预处理药物。
②每次输液前30分钟服用抗组胺药、H2拮抗剂、对乙酰氨基酚和止吐药。
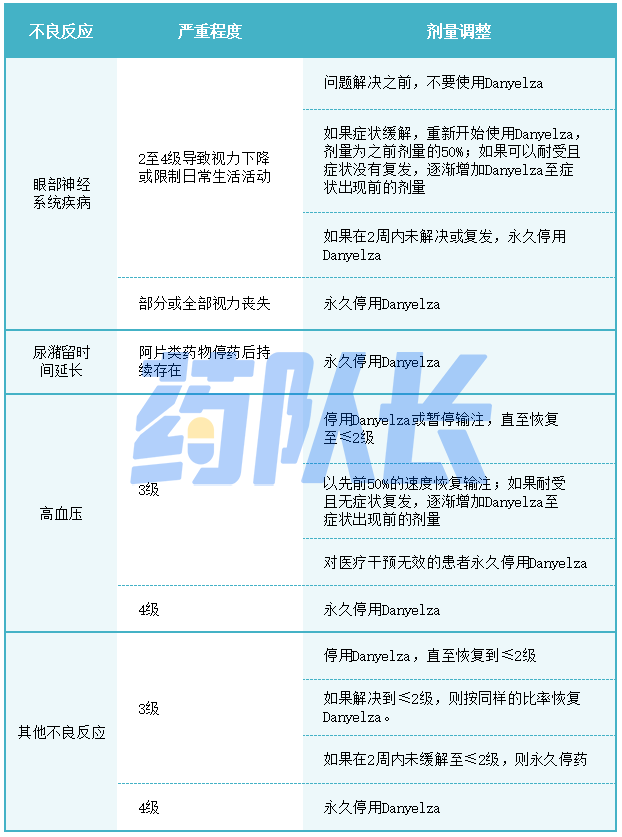
3.不良反应的剂量调整
表二 Danyelza针对不良反应的推荐剂量修改

4.准备工作
(1)使用适当的无菌技术。
(2)给药前目测药瓶是否有颗粒物和变色。如果溶液变色、混浊或含有微粒,请丢弃小瓶。
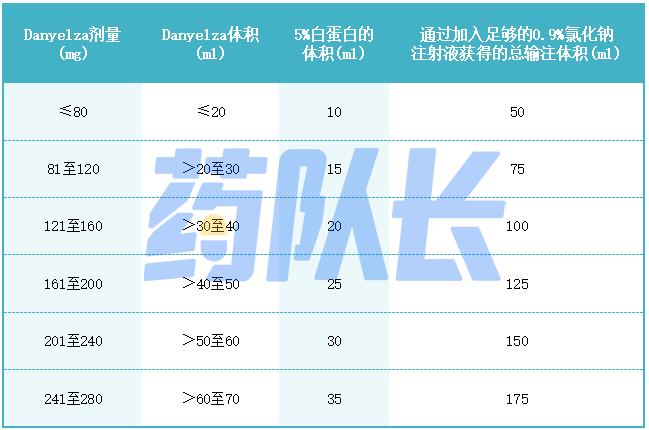
(3)将适量的5%人白蛋白,USP和0.9%氯化钠注射液,USP加入一个空的无菌静脉输液袋中,该袋应足够大,以容纳表3中所示相关剂量所需的容量。留出5-10分钟的被动混合时间。
(4)抽出所需剂量的Danyelza并注入装有5%人白蛋白,USP和0.9%氯化钠注射液,USP的输液袋中。丢弃小瓶中未使用的Danyelza。
表三 Danyelza的制备,4mg/ml
如果不立即使用,将稀释后的Danyelza输液液在室温下(15°C至25°C)保存8小时或冷藏(2°C至8°C)保存24小时。从冰箱中取出后,在8小时内开始输液。
5.管理
(1)按照建议将Danyelza作为稀释的静脉注射给药。不要以静脉推注或注射的方式给药。
(2)第一次输注(第1周期,第1天),在60分钟内静脉注射Danyelza。对于随后的输注,根据耐受情况在30至60分钟内静脉注射Danyelza。
(3)每次输液后观察患者至少2小时。
(三)适用人群
成人和1岁以上儿童。妊娠期、哺乳期女性,以及老人应在医生指导下用药。
(四)禁忌
对Danyelza有严重超敏反应史的患者禁用。
(五)副作用
最常见的不良反应(≥25%)是输液相关反应、疼痛、心动过速、呕吐、咳嗽、恶心、腹泻、食欲减退、高血压、疲劳、多形性红斑、周围神经病变、荨麻疹、发热、头痛、注射部位反应、水肿、焦虑、局部水肿和易怒。
最常见的3级或4级实验室异常(≥5%)是淋巴细胞减少、中性粒细胞减少、血红蛋白减少、血小板计数减少、钾减少、丙氨酸氨基转移酶升高、葡萄糖减少、钙减少、白蛋白减少、钠减少和磷酸盐减少。
(六)注意事项
1.严重的输液相关反应
(1)Danyelza可引起严重的输注反应,需要紧急干预,包括液体复苏、支气管扩张剂和皮质类固醇的使用、重症监护病房入院、输注速率降低或中断Danyelza输注。输液相关反应包括低血压、支气管痉挛、缺氧和喘鸣。
(2)建议预先使用抗组胺药、对乙酰氨基酚、H2拮抗剂和皮质类固醇。在有心肺复苏药物和设备的环境中,在每次Danyelza输注期间和完成后至少2小时内密切监测患者输注反应的体征和症状。
(3)根据严重程度降低剂量、中断输注或永久停用Danyelza,并根据需要进行适当的医疗管理。
2.神经毒性
Danyelza可引起严重的神经毒性,包括严重的神经性疼痛、横断面脊髓炎和可逆性后脑白质病综合征。
(1)疼痛
预先服用治疗神经性疼痛的药物(如加巴喷丁)和口服阿片类药物。根据需要静脉注射阿片类药物治疗突破性疼痛。根据严重程度永久停用Danyelza。
(2)横贯脊髓炎
Danyelza可发生横贯脊髓炎。发生横脊髓炎的患者永久停用Danyelza。
(3)可逆性后脑白质病综合征(RPLS)
在Danyelza输注期间和之后监测血压并评估神经系统症状。如果出现症状性RPLS,则永久停用Danyelza。
(4)外周神经病变
包括外周感觉神经病变、外周运动神经病变、感觉异常和神经痛,根据严重程度永久停用Danyelza。
(5)眼睛神经系统疾病
包括瞳孔不等、视力模糊、调节障碍、瞳孔散瞳、视力障碍和畏光在内的眼睛神经系统疾病。根据严重程度永久停用Danyelza。
(6)尿潴留时间过长
停用阿片类药物后尿潴留未解决的患者永久停用Danyelza。
3.高血压
高血压未控制的患者不要使用Danyelza。在输注期间监测血压,并在Danyelza每个周期的第1至第8天至少每天监测血压,并评估高血压并发症,包括RPLS。根据严重程度,中断Danyelza输注并以减慢的速度恢复,或永久停用Danyelza。
4.胚胎-胎儿毒性
基于其作用机制,Danyelza可能对孕妇造成胎儿伤害。告知有生育潜力的女性,包括孕妇,对胎儿的潜在风险。建议有生育潜力的女性在使用Danyelza治疗期间和最后剂量后两个月内使用有效的避孕措施。
(七)治疗效果
(1)试验设计
Danyelza联合GM-CSF的疗效在研究12-230(NCT01757626)中进行了评估,这是一项单中心、开放标签、单组试验,在骨或骨髓中复发或难治性高风险神经母细胞瘤患者亚群中,对先前的治疗表现出部分反应、轻微反应或疾病稳定。
(2)试验结果的设定
主要疗效结局指标为总缓解率(ORR)和缓解持续时间(DOR),由独立病理和影像学检查根据修订后的INRC确定,并由至少一次后续评估确认。
(3)试验结果
试验结果显示,总缓解率为34%,其中包括66%的完全缓解率,缓解持续时间超过6个月的患者比例为23%。
(八)药物相互作用
尚未明确
(九)储存条件
Danyelza注射液是一种无菌,不含防腐剂,透明至微乳白色,无色至微黄色的静脉输注溶液,盒装,含40mg/10ml(4mg/mL)单剂量小瓶,Danyelza在原包装中储存在2°C至8°C的冰箱中,避光直至使用,不要冷冻。
【温馨提示】:部分商品说明书更换频繁,请以商品实物为准。

- 【宫颈癌】ZG005[适 应 症]一线标准治疗失败的晚期宫颈癌[试验分期]Ⅰ期
- 【BRAF突变实体瘤】双机制ERK1/2抑制剂GH55[适 应 症]BRAF突变实体瘤[试验分期]Ⅰ期
- 实体瘤|KH801注射液[适 应 症]复发/难治性或转移性晚期实体瘤患者[试验分期]Ⅰ期
- 初治胃癌|CLDN18.2单抗ASKB589联合化疗+免疫治疗[适 应 症]不可切除的局部晚期、复发性或转移性胃及食管胃交界处腺癌[试验分期]Ⅲ期
- 弥漫大B细胞淋巴瘤|盐酸米托蒽醌脂质体[适 应 症]复发性/难治性弥漫大B细胞淋巴瘤[试验分期]Ⅱ期
- 宫颈癌|PD-1/TIGIT双抗ZG005[适 应 症]至少经一线标准治疗失败(既往需要接受过含铂方案的化疗)的复发转移性宫颈癌[试验分期]Ⅰ期、Ⅱ期