
摘要:(1)生成抗CD7蛋白表达阻断剂 (7PEBL)可阻止CAR-T细胞自杀,患者总体安全性较好(2)部分接受自然筛选CD7 CAR-T细胞疗法后异基因造血干细胞移植,至今未复发(3)通用型CAR-T疗法,发现在外周血、骨髓和脑脊液中观察到 CAR-T 细胞的稳健扩增以及CD7 + T淋巴母细胞的快速根除(4)直接在T细胞上转导的抗CD5 CAR客观缓解可达44%
7月18日,华中科技大学同济医学院附属同济医院联合举办的“济往开来”CAR-T大讲堂第三期,在线上如期进行,多个医院的专家和主任讨论了血液肿瘤的细胞免疫治疗新进展,本文就华中科技大学同济医学院附属同济医院黄亮教授的发言—《T细胞肿瘤的CAR-T细胞治疗综述》,进行了汇总和研讨。
黄亮教授—同济医院副主任医师
华中科技大学同济医学院附属同济医院博士、副教授、副主任医师、硕士生导师同济医院血液内科副主任,支部书记
专业方向:淋巴增殖性疾病及其免疫治疗
美国希望之城国家医学中心访问学者
中华医学会血液分会淋巴细胞疾病学组委员和青委会委员、中国抗癌协会血液肿瘤专业委员会青委会副主委、湖北省抗癌协会血液肿瘤专业委员会委员兼秘书、武汉市医学会血液学分会青委会副主委
以第一或通讯作者在Blood、 Cell Research、Blood Cancer Journal等期刊发表近二十篇SCI论文
主持国家自然科学基金委青年项目、面上项目和科技部863青年科学家专题项目获2019年度华中卓越学者计划晨星岗、2019年ASCO和2018年ASH的Abstract Merit Award,以及MMAAP基金会Hematology Fellowship Award
嵌合抗原受体(Chimeric antigen receptor-engineered, CAR) T细胞疗法从研发到临床应用,仅历时25年,该疗法对白血病和淋巴瘤细胞具有强大的杀伤作用[1],并于2017年获美国食品药品监督管理局(FDA)批准,在复发或难治性(R/R)B细胞肿瘤中取得了前所未有的成功。急性B淋巴细胞白血病(B-ALL)的患者应用CAR-T细胞疗法的完全缓解率(CR)甚至高达90%,而弥漫性大B细胞淋巴瘤(DLBCL)的客观缓解为76% ,CR也达到了47% ,因此CAR-T细胞治疗是当今最有潜力的细胞免疫疗法之一。
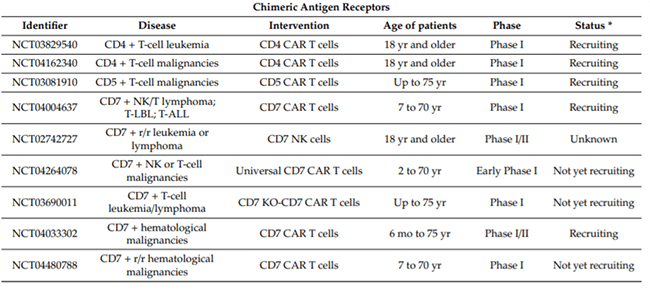
目前,多款CAR-T药物在中国进入临床试验阶段,中国已经超过美国(173项)成为全球 CAR-T 临床研究注册数量最多的国家[1]。但相较于B细胞肿瘤,T细胞肿瘤的研究相对较少,多数靶点处于临床前阶段,进入试验的主要靶点有CD4、CD5和CD7(表1)[2]。
(1)CAR-T自杀:由于其缺乏特异性靶点,恶性T细胞和正常T细胞或CAR-T细胞抗原表达谱之间存在重叠,在CAR-T制备过程中,以及在体内输注CAR-T后,都会导致CAR-T细胞本身的杀伤(互杀),亦称为“CAR-T自杀”,以至于治疗后出现T细胞缺乏,从而影响到该疗法的疗效。
(2)肿瘤细胞污染:提取T细胞时,因肿瘤细胞难以剥离,制备自体CAR-T还存在肿瘤细胞污染的风险
(3)肿瘤异质性
(4)抗原逃逸等...
均限制了CAR-T在T细胞肿瘤中的应用。
CD7几乎在所有T白血病和淋巴母细胞性淋巴瘤,以及部分外周T细胞淋巴瘤中都高度表达,此外,正常细胞中,T细胞、NK细胞和胸腺细胞上也有CD7表达,相对而言是一个比较好的靶点,能够在免疫细胞活化和相互作用的过程中起到一定的作用。
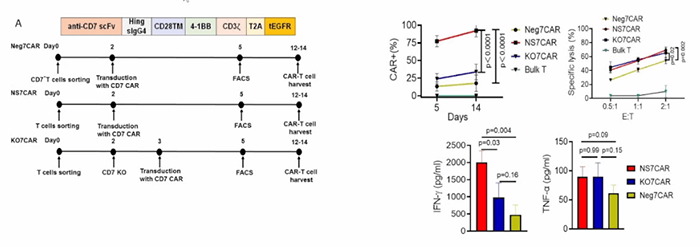
通过使用蛋白阻滞技术,抑制CD7表达,将本该在表面表达的CD7,“囚禁”在细胞内,产生自杀抵抗的抗CD7 CAR-T细胞,通过该方式制备的CAR-T细胞仍可在人体体外和小鼠体内杀伤肿瘤细胞,抑制CAR-T自杀提高了治疗血液系统恶性肿瘤的效能,体外效靶比 (效应细胞和靶细胞的比率) 也显示出良好的结果(图1)[3]。

抗 CD7 蛋白表达阻断剂 (7PEBL)
张明志教授在2020年62届ASH大会上公布了阻止 CAR-T 细胞自杀的首次人体临床试验,提出将靶向CD7的纳米抗体
(CD7Nb)与PEBL序列(ER/Golgi-retention motif peptide)重组融合,生成抗 CD7 蛋白表达阻断剂
(7PEBL),该阻断剂可诱导CD7在细胞内滞留,从而阻止CAR-T细胞自杀。
大会上报道了8例患者的使用情况,有2例患者治疗失败,6例治疗成功的患者中有5例达到微小残留病灶(MRD)阴性缓解, 在治疗后缓解仍然持续。并且只有1例患者在治疗后出现2级细胞因子释放综合征 (CRS) ,其他患者仅为1级,未发生神经毒性,总体安全性较好[4]。
供体来源的抗CD7嵌合抗原受体
潘静教授等人在《临床肿瘤学杂志》上,也发表了一篇评估供体来源的抗CD7嵌合抗原受体 (CAR)T细胞在 r/r T-ALL患者中的安全性和疗效的文章。
疗效结果
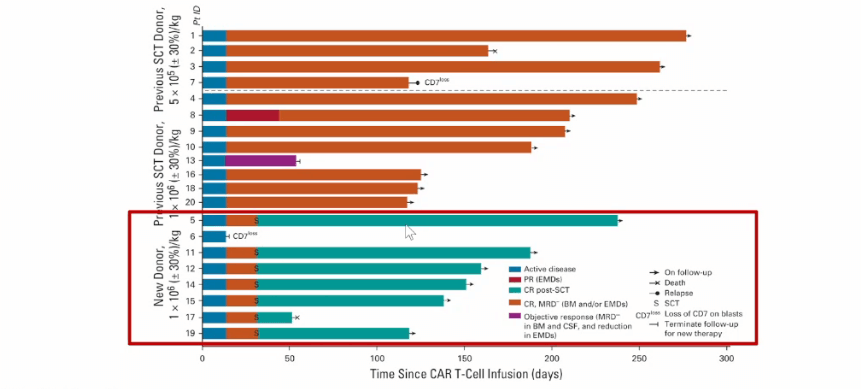
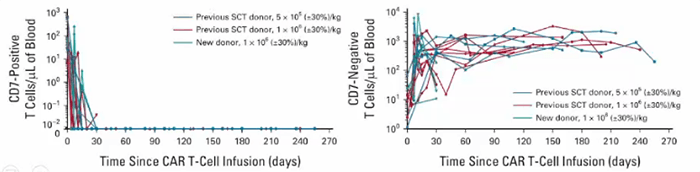
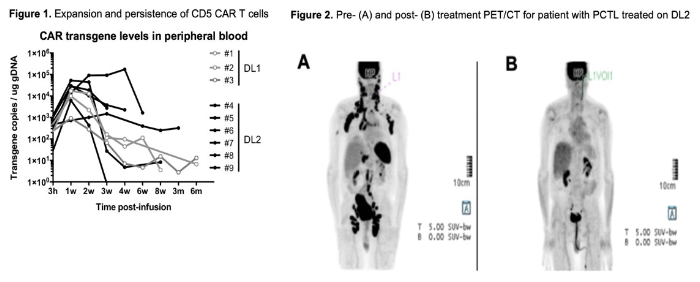
在其开展的临床试验中,20例患者接受了输注,90%(n=18) 的患者获得完全缓解,其中7例患者进行了干细胞移植。在中位随访6.3个月时,15例患者仍处于缓解状态(图3)。在输注后第6个月评估的5例患者中,仍可检测到CAR T细胞(图4)。这表明当患者的CD7阳性正常T细胞被耗尽时,CD7阴性T细胞扩增仍可缓解治疗相关的T细胞免疫缺陷。
安全性疗效
1-2级不良事件:所有患者中,有90%(n=18)的患者为1-2级CRS,15%(n=3)的患者出现1-2级神经毒性,60%(n=12)的患者发生1-2级移植物抗宿主病(GVHD),并且有20%(n=4)的患者发生病毒再激活。
3-4级不良事件:仅有10%(n=2)的患者发生3-4级不良事件,均为血细胞减少。
除了1例患者在输注后5.5个月死于真菌性肺炎相关肺出血,其他患者的所有不良事件均可逆[5]。
这项临床试验,证实了在r/r T-ALL患者中,供体来源的CD7 CAR T细胞表现出有效扩增,并获得了较高的完全缓解率和可控的安全性,因此越来越多的II期多中心试验正在进行。
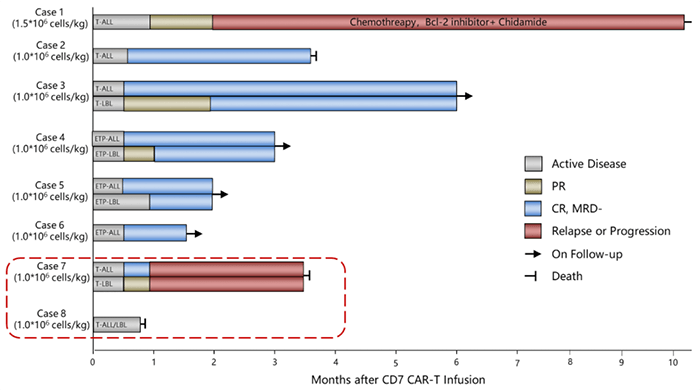
自然筛选CD7 CAR-T细胞是指自然选择的CD7 CAR-T细胞,无需额外的基因操作。《blood》杂志上公布了针对 T-ALL/LBL 未经基因操作的自然选择的CD7 CAR-T治疗的首次人体I期临床试验[6]。20例复发性/难治性T细胞急性淋巴细胞白血病(T-ALL,n=14)和淋巴母细胞淋巴瘤(T-LBL,n=6)患者接受了 T 细胞中衍生天然选择的 7CAR-T 细胞 (NS7CAR) 治疗。
疗效结果
19例患者在第28天达到骨髓微小残留病阴性完全缓解(CR),5例患者达到髓外CR。中位随访时间为输注后142.5天,14例患者在 NS7CAR 输注后接受了异基因造血干细胞移植,至今未复发。在未接受移植的6例患者中,4例在中位时间54(32-180) 天仍保持CR。
安全性结果
18例患者发生≤2级CRS,1例发生3级CRS,2例发生1级神经毒性(图5)。
该临床试验表明NS7CAR-T 治疗是 T-ALL/T-LBL安全、高效的治疗方法,但仍然需要更大的患者群体和更长的随访进行验证。
同种异体,又被称为“现货”(off-the-shelf)和通用型,是从健康的捐赠者那里收集T细胞或干细胞来源的T细胞,经过工程化设计表达CAR,以识别和摧毁癌细胞,并限制患者自身免疫反应,可立即使用,不需要为患者量身定制。2例接受通用型CAR-T同种异体——GC027治疗的复发性/难治性T-ALL患者的病例报告中:
疗效结果
2例患者均达到完全缓解,未检测到微小残留病。在外周血、骨髓和脑脊液中观察到CAR-T细胞的稳健扩增以及CD7+T淋巴母细胞的快速根除。
安全性结果
数据截止时,其中1例患者在CAR T细胞输注后持续缓解1年以上。此外,2例患者均发生了3级CRS,未观察到移植物抗宿主病[7]。
这表明,新型CD7靶向通用性同种异体CAR-T疗法,可为特定的复发/难治性 T-ALL 患者提供深度且持久的缓解,GC027可能是治疗难治性/复发性 T-ALL 的一种有前景的新选择。
大约80%的T细胞肿瘤,以及一些B细胞淋巴瘤中都能检测到CD5的表达。正常细胞的CD5表达仅限于胸腺细胞、外周T细胞和少量B淋巴细胞亚群,CD5可负向调节T细胞受体(TCR)和B细胞受体(BCR)信号。T细胞上可直接转导抗CD5 CAR,使CD5阴性的细胞自杀呈一过性(快速且短暂),从而在制备过程中获得相应的CAR-T细胞,并且抗CD5 CAR-T细胞,在体外和动物体内都能特异性地清除T细胞肿瘤(图6)[8]。
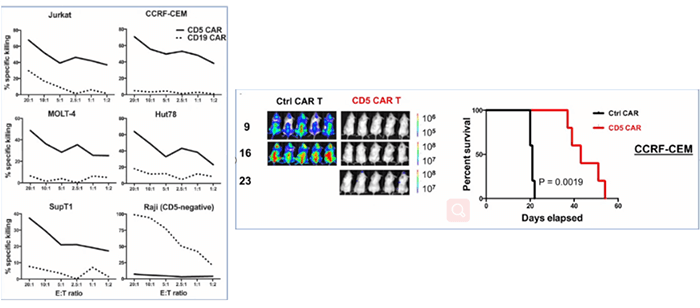
一项临床试验研发了第二代具有CD28共刺激内结构域的CD5特异性CAR,当在 T 细胞中表达时,可产生一过性自杀,研究共纳入了4例T-ALL和5例T-LBL患者,评估了用这些CD5 CAR T细胞治疗r/r T细胞恶性肿瘤患者的疗效,并讨论了此疗法作为异基因造血干细胞移植 (HSCT) 桥梁的安全性和可行性。
疗效结果
所有患者中,有4例患者达到客观缓解(44%) ,其中3例为完全缓解。
安全性结果
3例患者出现CRS,但均未出现严重的T细胞缺乏;
2例未接受造血干细胞移植达到完全缓解的患者,分别在回输后6周和7个月后CD5阳性肿瘤复发[9]。
这些结果表明,CD5 CAR T细胞是安全的,并且可以在重度治疗的r/rCD5+T-ALL和T-NHL患者中诱导临床缓解,而不会诱导完全的T细胞再生障碍。重要的是,CD5 CAR T细胞消除恶性T细胞,可使以前不符合条件的患者继续进行HSCT,但该疗效有限,缺乏更大的样本。
华中科技大学同济医学院附属同济医院进行的抗CD5 CAR-T(CT125)临床试验,也证实抗CD5 CAR-T细胞疗法能够很好地杀伤肿瘤细胞,但抗CD5 CAR-T细胞疗法存在肿瘤逃逸,肿瘤细胞(红色)治疗前为CD5阳性和CD7阳性,抗CD5 CAR-T治疗缓解后复发,肿瘤细胞CD5阴性,但CD7仍阳性(图8)。
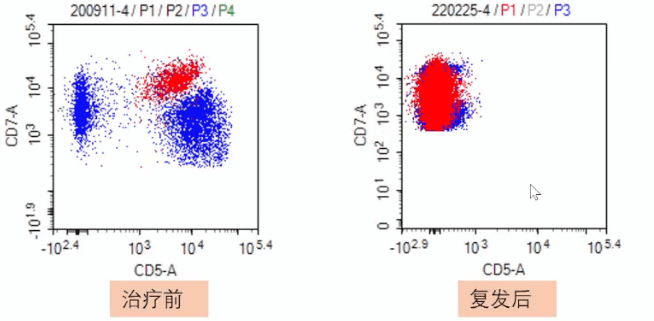
这表明未来仍需将优化靶抗原选择作为重点,改善抗肿瘤反应,减少抗原逃逸机制,从而减少复发[10]。现已提出双特异性靶点疗法,仍处于试验阶段,还未在人体应用。
CAR-T细胞疗法作为血液肿瘤的前沿技术,尤其是T细胞肿瘤的应用还处于早期阶段,面临多种挑战,比如预处理方案、靶点逃逸机制、免疫缺陷和免疫失衡、整体治疗地位等,都非常值得关注。由于T细胞肿瘤尚缺乏特异性靶点,需要克服自相残杀和T细胞免疫缺陷,现已提出通过基因编辑阻止自杀、“自然筛选”、导入“自杀基因”和联合靶向等技术,并在临床试验中,取得了不错的疗效和安全性。
但肿瘤逃逸仍然是CAR-T细胞疗法的首要难题,双特异性靶点的应用以及如何减少复发的研究都在如火如荼的开展。此外,创新型的yST、 TCR-Like CAR-T、通用型CAR-T和CAR-NK等细胞治疗产品有待探索,随着研究的不断深入,相信CAR-T细胞疗法将为血液肿瘤患者带来更璀璨的生命曙光。
